复星医药与BioNTech合作的同个疫苗尚未在中国开始临床试验。
在依旧缺乏“特效药”的情况下,新冠疫苗的疫苗开发“竞争”仍在加速。
美东时间5月5日上午,辉瑞和德国生物技术公司BioNTech合作开发的新冠mRNA疫苗宣布在美国完成第一批临床试验的受试者给药。此次试验属于针对新冠肺炎(COVID-19)的BNT162疫苗计划,是全球发展计划的一部分,在德国首批研究组的剂量已于上周完成。
这项研究旨在确定在一项连续研究中评估的四种mRNA候选疫苗的安全性、免疫原性和最佳剂量水平。该临床试验将入组360名健康受试者,纳入两个年龄组(18-55岁和65-85岁)。在研究的第一阶段接受免疫的首批受试者将是18-55岁的健康成年人。
一旦对给定剂量水平的候选疫苗进行了测试,并且对年轻人的剂量水平提供了安全性和免疫原性的初步证据,则只能使用给定剂量的候选疫苗进行免疫。目前向参与者投药的地点包括纽约大学格罗斯曼医学院和马里兰大学医学院。
辉瑞和BioNTech的开发计划包括四个候选疫苗,每个候选疫苗代表mRNA格式和靶抗原的不同组合。该试验的设计允许同时评估各种mRNA候选物,以便在大量志愿者中识别出最安全和潜在最有效的候选物,其方式将有助于与监管机构实时共享数据。
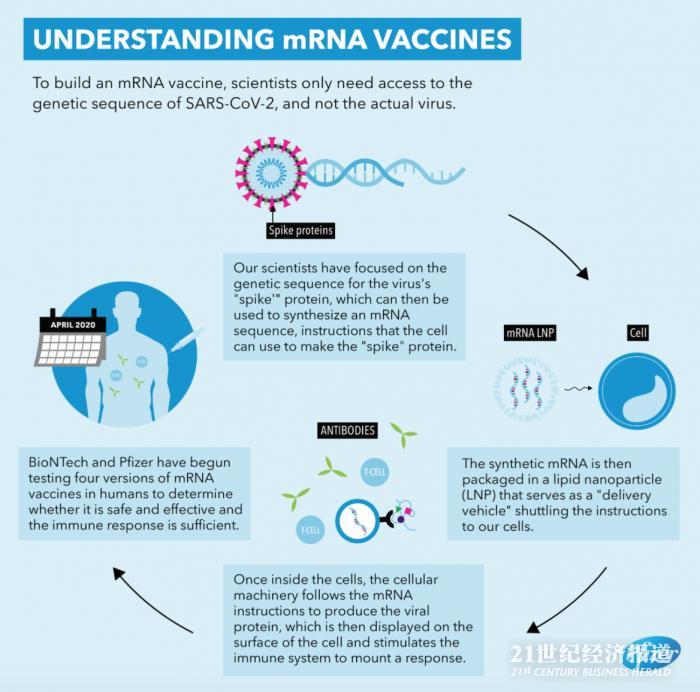
mRNA信息图(来源:辉瑞官网)
辉瑞董事长兼首席执行官Albert Bourla表示,“我们从欧洲乃至美国开始实施独特而强大的临床研究计划,我们期待与BioNTech的合作伙伴和监管机构共同快速发展,为最需要的患者提供安全有效的疫苗。在短短不到四个月的时间内,我们能够从临床前研究过渡到人体测试,这是非同寻常的,进一步表明了我们致力于从实验室到制造以及更多领域的一流资源的承诺。”
BioNTech首席执行官兼联合创始人Ugur Sahin表示,“我们已经能够在开发我们的mRNA平台方面运用十多年的经验,从而在如此短的时间内针对疫苗计划在多个地区启动一项全球临床试验。我们乐观地认为,将多种候选疫苗投入人体试验将使我们能够确定针对COVID-19的最安全、最有效的疫苗接种选择。”
在临床开发阶段,BioNTech将通过其在欧洲具有GMP认证的mRNA生产设施提供疫苗的临床供应。
在产能上,辉瑞和BioNTech称正在努力扩大生产规模,以供全球供应。辉瑞计划激活其广泛的制造网络并进行风险投资,该计划的广度应允许在2020年生产数百万剂疫苗,到2021年将增加到数亿剂。辉瑞在美国三个州(马萨诸塞州,密歇根州和密苏里州)和比利时普尔斯的生产基地已被确定为生产该疫苗的中心。
BioNTech和辉瑞将在监管部门批准后共同合作,在全球范围内将该疫苗商业化(不包括中国,BioNTech与复星医药就BNT162在临床开发和商业化方面进行了合作)。
2020年3月17日双方公布开始就该疫苗进行合作。根据双方此前公布的细节,该合作利用BioNTech的技术平台及辉瑞在疫苗研发、监管、全球生产和分销网络方面的优势。根据协议条款,辉瑞将向BioNTech支付1.85亿美元的预付款,其中包含7200万美元的现金付款和1.13亿美元的股权投资。BioNTech有资格获得高达5.63亿美元的未来阶段性付款(潜在总对价为7.48亿美元)。辉瑞和BioNTech将平均分担研发费用。辉瑞将在早期提供100%的研发成本,BioNTech将在疫苗商业化期间偿还辉瑞50%的研发费用。
在中国方面,复星拿到了该疫苗在中国开发和商业化的权利。
3月15日,复星医药宣布获得BioNTech许可在中国独家开发和商业化基于其专有的mRNA技术平台研发的针对COVID-19的疫苗产品。
根据协议,复星医药产业负责该疫苗在中国大陆及港澳台地区的该产品于区域内的临床试验、上市申请和市场销售,并承担相应的成本和费用。BioNTech将负责提供区域内临床试验申请所需的技术材料和临床前研究数据、配合区域内临床试验,并供应相关临床试验及市场销售所需的产品。
复星医药产业将向BioNTech支付至多8,500万美元的许可费(包括首付款、临床开发注册及销售里程碑款项),并在约定的销售提成期间内按该产品年度毛利的35%支付销售提成。与此同时,复星医药子公司拟认购BioNTech新增发行的1,580,777股普通股,认购金额约为5,000万美元。
mRNA是一种携带遗传信息的核酸分子。mRNA疫苗将遗传信息导入体内,使得体内细胞产生相应抗原,从而诱导人体产生中和抗体并刺激 T 细胞应答,通过体液免疫及细胞免疫的双重机制对抗病毒。面对突发的重大疫情,和传统疫苗相比,mRNA疫苗合成和生产工艺相对便捷,具有强大的免疫原性,不需要传统疫苗必需的附加佐剂,安全性好。
复星国际执行董事、联席首席执行官陈启宇此前在接受21世纪经济报道采访时表示,“春节前我们开会讨论怎么应对新冠疫情,大家比较一致的看法是mRNA疫苗可能会是一个技术上的机会。虽然我们自己还没来得及做,但是对这个技术平台还是有关注和跟踪。所以马上启动了跟全球在这个领域领先的公司的合作的沟通。我们没有去接触传统技术的疫苗,全部是新技术的疫苗,全部是核酸技术的公司,都谈了一遍。未来实际上mRNA这只是一个切入,它是一个平台,会诞生很多产品。我们还是会继续深度地关注。”
4月22日,BioNTech宣布获得德国监管机构Paul-Ehrlich-Institut批准,可以开始进行其mRNA疫苗的人体临床试验。对于中国何时开始临床试验,复星医药方面称,“作为BioNTech中国合作伙伴,我们希望未来能努力加快该疫苗在中国展开临床试验。”
(作者:卢杉 编辑:徐旭)