2013诺贝尔生理学与医学奖授予3名美德科学家
 2013诺贝尔生理学或医学奖得主
2013诺贝尔生理学或医学奖得主 生物体内细胞的正常运转有赖于让合适的分子在合适的时间抵达合适的位置。一部分分子,如胰岛素,需要被转运出细胞之外,而其他分子则需要被在细胞内部进行运输。细胞内部产生的分子被包裹于囊泡之中(图中蓝色表示),但是这些囊泡具体是如何达成这种精准的运输的?这一点一直没有被理解。
生物体内细胞的正常运转有赖于让合适的分子在合适的时间抵达合适的位置。一部分分子,如胰岛素,需要被转运出细胞之外,而其他分子则需要被在细胞内部进行运输。细胞内部产生的分子被包裹于囊泡之中(图中蓝色表示),但是这些囊泡具体是如何达成这种精准的运输的?这一点一直没有被理解。 Randy W. Schekman发现基因控制下的蛋白质在这种囊泡运输机制中起到重要作用。正如这里的图上所展示的那样,通过对比正常酵母菌细胞(左)和转运机制缺陷的细胞(右),他成功识别出操控这一转运过程的基因。
Randy W. Schekman发现基因控制下的蛋白质在这种囊泡运输机制中起到重要作用。正如这里的图上所展示的那样,通过对比正常酵母菌细胞(左)和转运机制缺陷的细胞(右),他成功识别出操控这一转运过程的基因。 James E. Rothman发现一种蛋白质化合物(图中橘色表示)可以让囊泡实现与目标细胞膜的融合。囊泡上的蛋白质物质会与目标细胞膜上的特定蛋白质之间发生结合,从而让囊泡可以在正确的位置上释放其所运载的特殊“分子货物”。
James E. Rothman发现一种蛋白质化合物(图中橘色表示)可以让囊泡实现与目标细胞膜的融合。囊泡上的蛋白质物质会与目标细胞膜上的特定蛋白质之间发生结合,从而让囊泡可以在正确的位置上释放其所运载的特殊“分子货物”。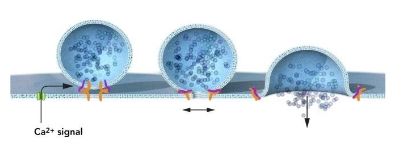 Thomas C. Südhof研究了大脑中神经细胞之间是如何互相传递信号的,以及钙离子在这一过程中所起的作用。他识别出一种分子机制(图中用紫色表示),其可以对进入的钙离子发生反应并触发囊泡融合,从而解释了囊泡输运机制中时间的精确性是如何达成的,以及其所携带的信号分子物质是如何能做到受控释放。
Thomas C. Südhof研究了大脑中神经细胞之间是如何互相传递信号的,以及钙离子在这一过程中所起的作用。他识别出一种分子机制(图中用紫色表示),其可以对进入的钙离子发生反应并触发囊泡融合,从而解释了囊泡输运机制中时间的精确性是如何达成的,以及其所携带的信号分子物质是如何能做到受控释放。新浪科技讯 北京时间10月7日消息,据诺贝尔奖官方网站报道,2013诺贝尔生理学或医学奖今日公布,得主为James E. Rothman, Randy W. Schekman & Thomas C. Südhof,得奖原因为他们发现了细胞内的运输机制之谜。
生物体内每一个细胞都是一个生产和输出分子的工厂。比如,胰岛素在这里被制造出来并释放进入血液当中,神经传递素从一个神经细胞传导至另一个细胞。这些分子在细胞内都是以“小包”的形式传递的,这就是“细胞囊泡”。这三位获奖科学家发现了这些“小包”是如何被在正确的时间输运至正确地点的分子机制。
Randy Schekman发现了一系列与细胞囊泡输运机制有关的基因;James Rothman发现了让这些囊泡得以与其目标相融合的蛋白质机制,从而可以实现对所运“货物”的传递;Thomas Südhof则揭示了信号是如何实现对囊泡的控制,使其得以精确分配其所载“货物”。
在这项发现过程中,三位科学家:Rothman, Schekman 和Südhof揭示了细胞内输运体系的精细结构和控制机制。这一系统的失稳将导致有害结果,如神经系统疾病,糖尿病或免疫系统紊乱。
细胞内物质输运是如何实现的?
正如在一个繁忙的大型港口,你必须要有一套体系来确保你的货物会在规定的时间被配送到规定的位置,细胞也是一样。细胞内有各种复杂的细胞器,它们面临的问题是相似的:细胞会产生出各种不同的分子,如荷尔蒙,神经传递素,细胞活素以及酶,它们必须被传递至细胞内不同的位置上,或者需要被精确地在正确的时间转运至细胞外部。在这一过程中,时间和地点的正确是最关键的。这就要依赖于囊泡的作用,这是一些微小的小泡结构,外部有膜包裹,它们负责在各细胞器之间运输细胞内部的“货物”,或是通过与细胞膜的融合从而向细胞外部释放细胞内产生的物质。这一机制至关重要,如它控制着神经传递素的传递,后者是激发生物体神经系统反应的触发开关;又或者在新陈代谢方面,它控制着荷尔蒙的分配传递。那么这些囊泡结构究竟是如何能确保运输的时间和地点正确性的呢?
交通堵塞背后的基因控制机制
早在上世纪的1970年代,Randy Schekman便被细胞如何调节其内部输运机制深深吸引并投身此项研究,并试图利用酵母菌作为模型样本来研究其背后的基因机制。在基因筛选中,他找到一些显示出输运机制缺陷的酵母菌细胞,其表现就像是一个缺乏指挥协调而一片混乱的公共交通系统,其内部囊泡堆积在细胞内的部分区域。他发现造成这种囊泡发生“交通堵塞”的原因是基因层面的,并据此顺藤摸瓜找到了其背后的基因机制。他找到了3组不同的基因对这一细胞运输机制产生作用,从而改变并大大加深了我们对细胞如何规范其内部输运系统的认识。
精确对接
James Rothman同样对细胞输运机制感到好奇。在上世界80~90年代期间,Rothman正开展对哺乳动物细胞囊泡输运机制的研究,他发现一种蛋白质可以让囊泡实现与其目标细胞膜的对接和融合。在融合过程中,囊泡上的蛋白质和细胞膜上的蛋白质相互结合,就像分开的拉链相互咬合一样。这类蛋白质有很多种,并且只有当合适的配对出现时才会发生融合,这就确保了“货物”只会被运输到设定的位置上而不会出现错误。这一机制不管是在内部细胞器之间的运输,还是向外的运输过程中都会起作用。
随后的研究发现,Schekman在酵母菌细胞内所发现的部分基因正是产生Rothman在哺乳动物细胞内发现的蛋白质的背后机制,这揭示了一项细胞输运体系内古老的进化起源。至此,这两位科学家的研究工作描绘了细胞输运体系的关键环节。
时间就是一切
Thomas Südhof对大脑内神经细胞是如何相互之间进行沟通感兴趣。这种传递信息的物质被称为神经传递素,这种特殊分子正是由囊泡负责运输至神经细胞的细胞膜上并借助融合机制向外释放的。这正是Rothman 和Schekman所发现的机制。然而这些囊泡只有在其所在的神经细胞向其“邻居”发送信号之后才会被允许释放它们运载的“货物”。这种精确的时机把握究竟是如何实现的?
科学家们此前便已经知道钙离子参与了这一过程,在上世纪90年代,Südhof便开始在神经细胞中寻找对钙离子敏感的蛋白质。最终他识别出一种分子机制,其会对注入的钙离子做出反应,并控制邻近的蛋白质迅速让囊泡与神经细胞的外部细胞膜相结合。于是“拉链”打开了,信号物质被释放出去。Südhof的发现解释了这种细胞传输的时间精确性是如何实现的,以及囊泡中的物质是如何实现受控地释放。
囊泡输运机制与疾病过程
今年的3位诺奖获奖科学家发现了细胞生理学过程中的一项关键过程。他们的工作揭示了细胞内部和外部的输运体系是如何达成时间与位置上的精确性的。在细胞中,不管是酵母菌还是人类,不管高等生物还是低等生物,它们体内的囊泡输运以及细胞膜融合机制都遵循相同的基本原理。这一体系对于一系列的生理过程而言都至关重要,从大脑信号的传递,到荷尔蒙的释放,再到免疫细胞活素。但当发生疾病时,细胞内的囊泡输运机制会出现问题,这当中包括一些神经系统和免疫系统疾病。离开这一堪称完美的控制机制,细胞将陷于混乱。
获奖科学家简历:
James E. Rothman,1950年出生于美国马萨诸塞州Haverhill,他于1976年在哈佛大学医学院获得博士学位,随后在麻省理工学院做博士后研究工作。1978年Rothman前往加州的斯坦福大学,并在那里开始进行针对细胞囊泡的研究工作。Rothman还曾经在普林斯顿大学以及纪念斯隆-凯特林癌症研究所和哥伦比亚大学工作过。2008年,他开始在耶鲁大学任职,目前是耶鲁大学细胞生物学系系主任和教授。
Randy W. Schekman,1948年生于美国明尼苏达州St Paul,曾先后在加州大学洛杉矶分校以及斯坦福大学求学,并于1974年获得博士学位,指导老师为Arthur Kornberg,后者是1959年度诺贝尔奖获得者。1976年,Schekman前往加州大学伯克利分校任职,目前他仍然是该校分子与细胞生物学系教授。同时Schekman也是霍华德休斯医学研究所研究员。
Thomas C. Südhof,1955年生于德国哥廷根。他在哥廷根大学求学并于1982年获得硕士学位,同年获得该校神经化学博士学位。1983年他前往美国达拉斯的德州大学西南医学研究中心开展博士后研究,其导师是Michael Brown和Joseph Goldstein,他们是1985年度诺贝尔生理学与医学奖得主。Südhof在1991年成为霍华德休斯医学研究所研究员,并在2008年开始担任斯坦福大学分子与细胞生理学教授。(晨风)
原文:http://www.nobelprize.org/nobel_prizes/medicine/laureates/2013/press.html
相关阅读:科学家争议诺奖设置缺陷:为何没有数学奖